Ecuaciones de estado
Publicado el 1 de febrero por Richard ‐ 2 min. de lectura
Las ecuaciones de estado modelan el comportamiento de una sustancia y se pueden representar de la siguiente manera:
$$ \begin{align} f(p,V,T)=0 \end{align} $$
donde:
- $p$ es la presión.
- $V$ es el volumen.
- $T$ es la temperatura.
Ecuación de estado térmica
Partiendo de la ley de gas ideal:
$$ \begin{align} p=\dfrac{n RT}{V} \end{align} $$
la cual podemos expresar de la siguiente forma:
$$ \begin{align} pV=nRT \end{align} $$
la cual es conocida como ecuación de Clapeyron-Mendeleiev. Donde:
$$ \begin{align} n=\dfrac{m}{M}=\dfrac{\text{masa de la sustancia}}{\text{masa molar}} \end{align} $$
Ecuación de estado calórica
La ecuación de estado calórica se expresa de la siguiente forma:
$$ \begin{align} U=U_0+C_v(T-T_0) \end{align} $$
esta ecuación se demostrará mas adelante.
- $U$ es la energía interna.
- $C_v$ es la capacidad calorífica a $V=cte$.
Procesos Termodinámicos
- Isotérmico ($T=cte$).
- Isobárico ($p=cte$).
- Isocórico ($V=cte$).
- Politrópico ($C=cte$).
- Adiabático $\left(C=\dfrac{\delta Q}{dT}=0\right)$.
Proceso Isotérmico (T=cte)
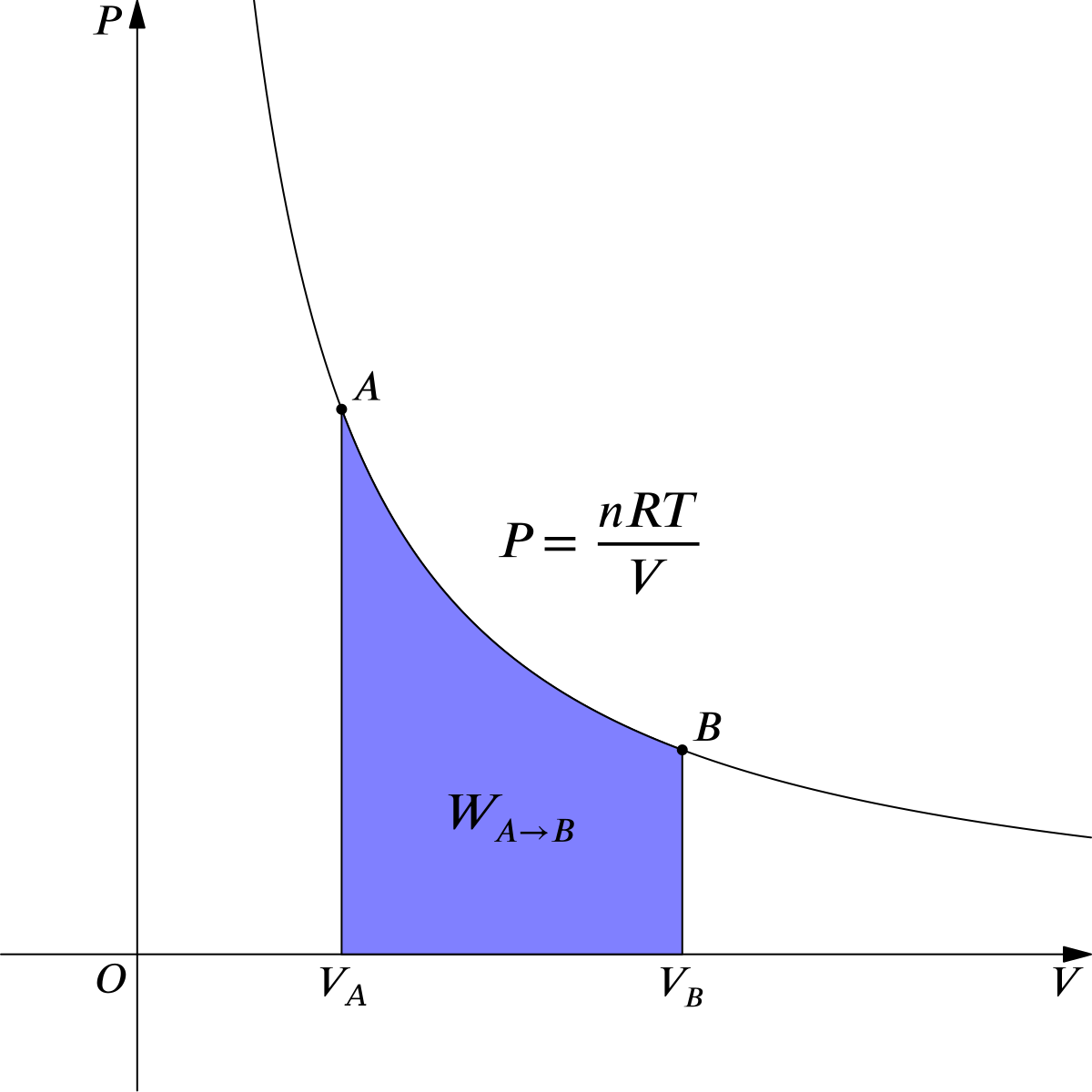
Partiendo de la ecuación de Clapeyron-Mendeleiev, como $T=cte$ entonces $nRT=c_1$
$$ \begin{align} pV=nRT=c_1 \end{align} $$
De modo que:
$$ \begin{align} pV=c_1 \rightarrow p=\dfrac{c_1}{V}=p(V) \end{align} $$
donde $c_1=nRT$.
Proceso Isobárico (p=cte)
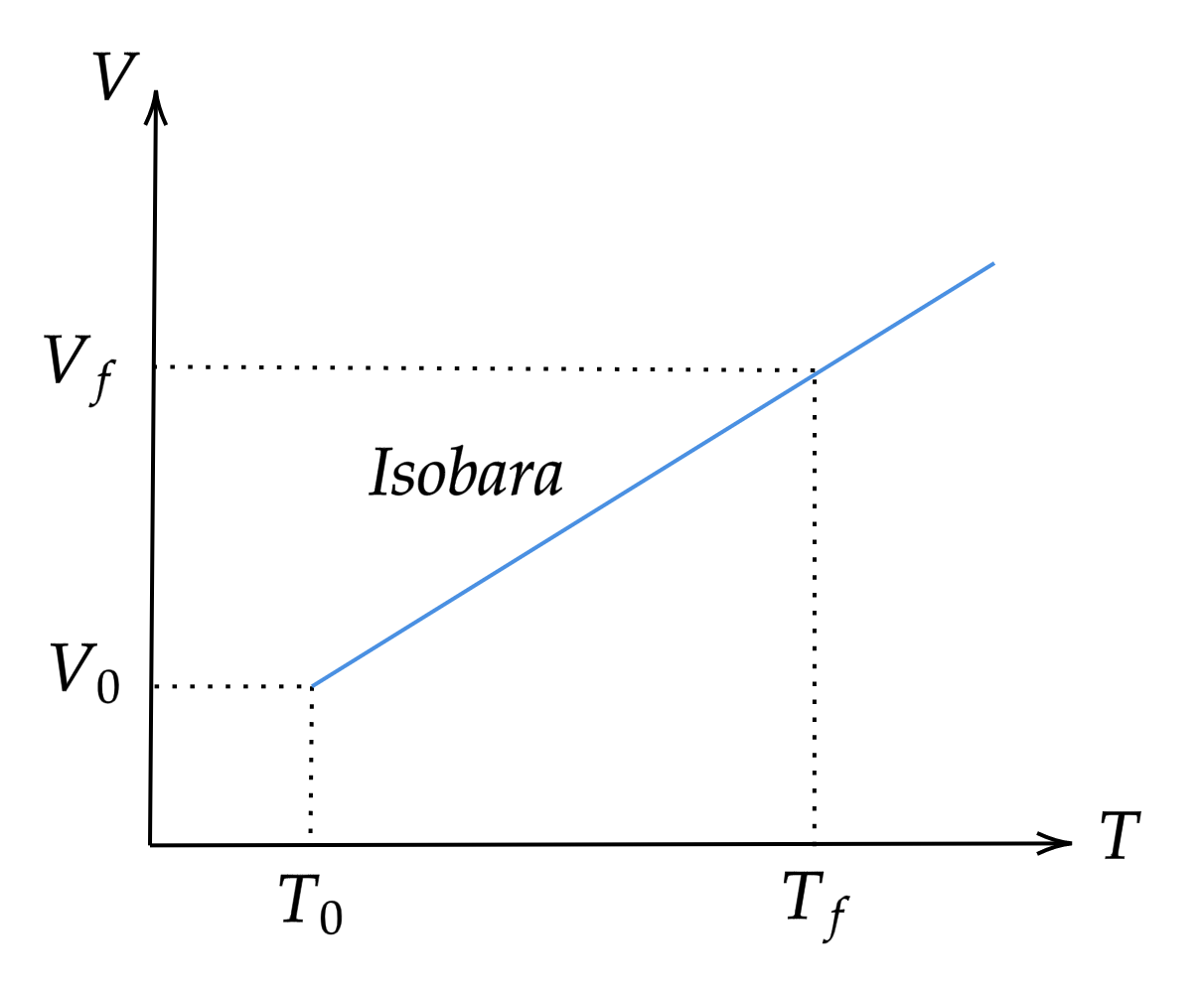
Partiendo de la ecuación de Clapeyron-Mendeleiev, como $p=cte$ entonces:
$$ \begin{align} pV=nRT \rightarrow V=\dfrac{nRT}{p} \end{align} $$
donde $\dfrac{nR}{p}=cte=c_2$, entonces:
$$ \begin{align} V=\dfrac{nRT}{p}=c_2 T=V=f(T) \end{align} $$
Proceso Isocórico

Partiendo de la ecuación de Clapeyron-Mendeleiev, como $V=cte$ entonces:
$$ \begin{align} pV=nRT \rightarrow p=\dfrac{nRT}{V} \end{align} $$
donde $\dfrac{nR}{V}=cte=c_3$, entonces:
$$ \begin{align} p=\dfrac{nRT}{V}=c_3 T=f(T) \end{align} $$